15.10.2010
Fördert Eutrophierung den Asiatischen Marienkäfer Harmonia axyridis?
Thomas Meineke
Seit etwa zehn Jahren breitet sich der Asiatische Marienkäfer Harmonia axyridis auch in Europa vehement aus [17]. Hier ab 1982 gezüchtet und in den 1990er Jahren erstmals zur biologischen Bekämpfung von Blattläusen an Kulturen in Gewächshäusern wie im Freiland eingesetzt, erscheinen die Nachkommen entlassener oder entwichener Individuen nun alljährlich im Herbst auf der Suche nach Winterquartieren zu Hunderten oder gar Tausenden in Gebäuden [1]. Fachleute befürchten, der gefräßige und wehrhafte Fremdling könne einheimische Arten verdrängen, gleichgültig ob Kommensale oder Beute [16]. Neue Untersuchungen zeigen indes, dass der primär blattlausfressende und fakultativ polyphage Harmonia axyridis zumindest Massenvermehrungen schädlicher Pflanzensaftsauger weder zu verhindern noch ausreichend einzudämmen vermag [11], [12].

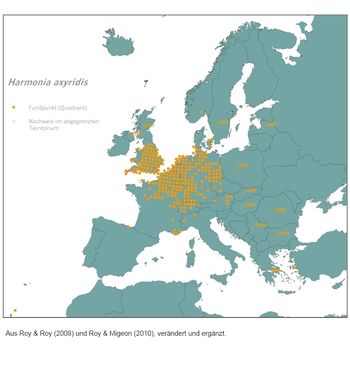
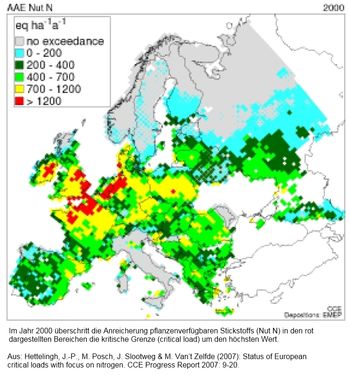
Die Zentren seines Auftretens in Europa weisen eine weitgehende Übereinstimmung auf mit den von erhöhten Stickstoffeinträgen betroffenen Großräumen (vergleiche die beiden folgende Abbildungen). Möglicherweise besteht also ein Zusammenhang zwischen dem anthropogenen Überangebot pflanzenverfügbaren Nährstoffes und dem Vermehrungs- bzw. Ausbreitungserfolg des kunterbunten Neubürgers.
Viele Blattlausarten entwickeln sich nur auf Pflanzengewebe, das über ausreichend hohe Mengen gelöster Stickstoffverbindungen verfügt [6]. Jeder Hobby-Gärtner weiß aus lehrreicher Erfahrung, dass zu hohe Nährstoffgaben den Befall durch die unerwünschten Schadinsekten begünstigen. Zu diesen zählt die weit verbreitete Mehlige Pflaumenblattlaus Hyalopterus pruni [19], [3]. Ratgeber empfehlen als vorbeugende Maßnahme zur Vermeidung ihres Auftretens unter anderem eine „zurückhaltende Stickstoffdüngung” [7]. Zwischen Mitte Juni und Anfang Juli verlässt das Insekt die Obstbäume und befällt im Wasser stehende Schilfpflanzen Phragmites australis. Der Wechsel ist eine Anpassung an den sich ändernden Gehalt löslichen Stickstoffs in beiden Wirten [6]. In den Pflaumen- und Zwetschgengehölzen sinkt er zu Beginn des Sommers rasch, steigt aber gerade dann in der sich vergleichsweise spät entwickelnden Röhrichtpflanze. Die „stickstoffbegierigen” Pflaumenblattläuse suchen zielstrebig Schilfbestände an nährstoffreichen Gewässern auf. Hingegen meiden sie die auf meso- und mäßig eutrophen Standorten weniger wüchsigen Pflanzen [13], [14]. Jedes Weibchen gebärt 30 bis 40 sich wiederum rein parthenogenetisch fortpflanzende Nachkommen in einer Folge von bis zu sechs Generationen [5], [14]. Gegebenenfalls noch gefördert durch warme, niederschlagsarme Witterungsbedingungen kann eine auf ein Schilfblatt gelangte Hyalopterus pruni also theoretisch bis zu 50 Millionen Abkömmlinge erzeugen. Dem Asiatischen Marienkäfer eröffnet sich im gegebenen Zeitfenster also ein schier unerschöpfliches Nahrungsangebot.
Am Seeburger See im Landkreis Göttingen konnte man Ende August 2010 entlang eines 15 Meter langen Uferröhrichts auf den oberen Schilfblättern mühelos etliche Eiablagen, etwa 40 Larven, 20 Puppen und mindestens 100 erwachsene Individuen des neobiotischen Käfers zählen. Sichtkontrollen an anderen Stellen des Gewässers ergaben ähnliche Werte, so dass zu diesem Zeitpunkt sicherlich weit über 30.000 Harmonia axyridis das Seeufer bevölkerten. Nach entsprechender Hochrechnung betrug die Anzahl der Pflaumenblattläuse am Kontrolltag mehr als 50 Millionen. Diese selbst den Bedarf des inzwischen auch im südlichen Niedersachsen wohl häufigsten Marienkäfers bei weitem übertreffenden Hyalopterus pruni-Massen sind am Seeburger See ein „neuzeitliches” Phänomen. Noch vor 35 Jahren erschien diese Blattlaus hier unregelmäßig und vergleichsweise unauffällig. Seit etwa 1990 lässt sich eine über die Jahre zunehmende Befalls- und Individuendichte feststellen, mittelbar auch erkennbar an vermehrt geschwärzten Blättern infolge der Ansiedlung von Rußtaupilzen auf den Blattlausausscheidungen. Sie geht einher mit dem durch das erhöhte Stickstoffangebot veränderten Wuchs der Schilfpflanzen.

Der Wandel des knapp 90 ha großen Sees von einem mäßig eutrophen zu einem hypertrophen Stillgewässer blieb achtsamen regelmäßigen Besuchern nicht verborgen: Zog sich zunächst die anspruchsvollere Unterwasservegetation zurück, brach alsbald die Population der einst in großer Anzahl vertretenen Dreiecksmuschel zusammen. Schließlich folgten Massenwachstum von Blaualgen und Massensterben der vergleichsweise robusten Großen Teichmuschel einschließlich verschiedener Fischarten. Was kritische Beobachter bereits vor Jahrzehnten prognostizierten und nach drastisch-evidentem Eintreten breite Bevölkerungskreise bewegte, fand schließlich in eigens angefertigten Fachgutachten Bestätigung [4], [8].
Die Frage nach einem Zusammenhang zwischen großräumiger Nährstoffanreicherung und dem Vermehrungs- bzw. Ausbreitungserfolg des Asiatischen Marienkäfers lässt sich allein auf der Grundlage der beschriebenen Wahrnehmungen nicht mit ja oder nein beantworten. Denn ein komplexes Geflecht weiterer und hier unerwähnter Faktoren steuert das Ausmaß von Schilfwachstum, Blattlausbefall und Fortpflanzungserfolg des räuberischen Kerbtieres. Gleichwohl sollten an einem meso- bis mäßig eutrophen Stillgewässer mit entsprechend schwachwüchsigeren Schilfbeständen blattlausfressende Insekten kein oder ein deutlich vermindertes Nahrungsangebot vorfinden und sich dann nicht bzw. weniger zahlreich vermehren. Die Karte zum Überangebot pflanzenverfügbaren Stickstoffes bezieht sich vor allem auf Einträge, die über den Luftweg erfolgen. In den Seeburger See gelangende N-Verbindungen und weitere Nährstoffe dürften indes vorwiegend dem größtenteils landwirtschaftlich genutzten Einzugsgebiet entstammen. Ihren Weg in das Stillgewässer finden sie über einspeisende Fließgewässer, Überläufe, Dränagen und Grundwasserflüsse.

In Gewässerökosystemen vollziehen sich tiefgreifende Veränderungen dann, wenn zum Abbau der nach Aufdüngung im Übermaß produzierten Biomasse nicht mehr genügend Sauerstoff zu Verfügung steht. Atmende Organismen verschwinden. Zwar vermag beispielsweise das Schilf bis zu einem gewissen Grad auch in anaeroben Gewässern zu gedeihen, da es über Markröhren bzw. Durchlüftungsgewebe seine Wurzeln mit Luftsauerstoff versorgt [15]. Es kann daher einen wichtigen Beitrag zum Abbau organischer Substanz zu anorganischem Material leisten und findet dementsprechend in Pflanzenkläranlagen Verwendung. Steigt jedoch die Konzentration des unter hypertrophen Bedingungen entstehenden toxischen Schwefelwasserstoffes, verlieren die Schilfrhizome zunächst an Elastizität und sterben schließlich ab [1], [10], [18]. Beginnende Schädigungen führen zur Herauslösung einzelner Wurzelballen aus dem Röhrichtverband. Am Seeburger See in den letzten Jahren vermehrt zu beobachtende Auflösungserscheinungen des Uferschilfes dokumentieren zu einem Teil möglicherweise den Beginn dieses Prozesses.
Zitierte Quellen
[1] Boon, P. I. (2006): Biogeochemistry and bacterial ecology of hydrologically dynamic wetlands. – In: D. P. Batzer and R. R. Sharitz (Editors): Ecology of freshwater and estuarine wetlands. University of California Press, Berkeley, p. 115-176.
[2] Brown P. M. J., T. Adriaens, H. Bathon, J. Cuppen, A. Goldarazena, T. Hagg, M. Kenis, B. E. M. Klausnitzer, I. Kovář, A. J. Loomans, M. E. N. Majerus, O. Nedved, J. Pedersen, W. Rabitsch, H. E. Roy, V. Ternois, I. Zakharov & D. B. Roy (2008): Harmonia axyridis in Europe: spread and distribution of a non-native coccinellid. Biocontrol 53: 5–21.
[3] Coates, W. W., R. A. Van Steenwyk, W. J. Bentley, K. R. Day, K. A. Kelley & J. L. Caprile (2007): Apricot – Mealy Plum Aphid. Scientific Name: Hyalopterus pruni. UC IPM Pest Management Guidelines: Apricot. UC ANR Publication 3433. UC IPM Online – University of California Statewide integrated Pest Management Program.
[4] Coring, E. & J. Bäthe (2007): Abschlussbericht zum Untersuchungsauftrag „Ökologisch-limnologische Untersuchungen am Seeburger See und ausgewählten Gewässern in seinem Einzugsgebietwww.landkreis-goettingen.de/magazin/artikel.php?menuid=128&topmenu=12&artikel=548.
[5] Dill, W. (1937): Der Entwicklungsgang der Mehligen Pflaumenblattlaus Hyalopterus arundinis FABR. im Schweizerischen Mittelland. Promotionsarbeit, Eidgenössische Technische Hochschule in Zürich, 88 S.
[6] Dixon, A. F. G. (1976): Biologie der Blattläuse. Stuttgart, New York, 82 S.
[7] Häseli, A. & C. Daniel (2009): Pflanzenschutz im Biosteinobstanbau. Forschungsinstitut für biologischen Landbau (FiBL), Merkblatt, Frick, 20 S.
[8] Hartmann, R. (2007): Abschlussbericht der hydrochemischen Untersuchungen im Bereich des Seeburger Sees im Landkreis Göttingen und dessen Zuflüsse erstellt im Auftrage des Landkreises Göttingen, Umweltamt. www.landkreis-goettingen.de/magazin/artikel.php?menuid=128&topmenu=12&artikel=548.
[9] Hettelingh, J.-P., M. Posch, J. Slootweg & M. Van’t Zelfde (2007): Status of European critical loads with focus on nitrogen. – In: J. Slootweg, M. Posch & J.-P. Hettelingh (Eds.): Critical Loads of Nitrogen and Dynamic Modelling. CCE Progress Report 2007: 9-20.
[10] Hürlimann, H. (1951): Zur Lebensgeschichte des Schilfs an den Ufern der Schweizer Seen. Dissertation Universität Zürich, Bern, 231 S.
[11] Latham, D. R. (2008): Biological control of the mealy plum aphid, Hyalopterus pruni Geoffrey. Dissertation, University of California, Berkeley, 169 S.
[12] Latham, D. R. & N. J. Mills (2010): Quantifying aphid predation: the mealy plum aphid Hyalopterus pruni in California as a case study. Journal of Applied Ecology 47: 200-208.
[13] Mook, J. H. (1971): Influence of environmental on some insects attacking Common Reed (Phragmites communis Trin.). Hidrobiologia 12: 305-312.
[14] Pintera, A. (1973): Seasonal dynamics of the mealy plum aphid population on reeds at the Opatovický pond (1968-1971). – In: Hejny, S. (Ed.): Ecosystem Study on Wetland Biome in Czechoslovakia. Czechosl. IBP/PT-PP Report No 3: 231-232.
[15] Ostendorp, W. (1993): Schilf als Lebensraum. Beihefte zu den Veröffentlichungen für Naturschutz und Landschaftspflege in Baden-Württemberg 68: 173-280
[16] Roy, H. & A. Migeon (2010): Ladybeetles (Coccinellidae) Chapter 8.4. In: Roques, A., M. Kenis, D. Lees, C. Lopez-Vaamonde, W. Rabitsch, J.-Yves Rasplus & D. B. Roy (Eds.): Alien terrestrial arthropods of Europe. BioRisk 4: 293-313.
[17] Roy, H. & D. Roy (2008): Harmonia axyridis. Delivering Alien Invasive Species Inventories for Europe (DAISIE). [Steckbrief mit Karte] www.europe-aliens.org/pdf/Harmonia_axyridis.pdf
[18] Van der Putten, W. (1997): Die-back of Phragmites australis in European wetlands: an overview of the European Research Programme on Reed Die-back and Progression (1993–1994). Aquatic Botany 59: 263-275.
[19] Weis, S. (1955): Die Blattläuse Oberösterreichs I. Österreichische Zoologische Zeitschrift 5: 464-559.
 UBS • Dr. Thomas Meineke
UBS • Dr. Thomas Meineke